- 1. Czym jest audyt wewnętrzny w branży life science?
- 2. Dlaczego audyt w farmacji jest wyjątkowy?
- 3. Jak zapewnić niezależność audytu wewnętrznego?
- 4. Najważniejsze wymagania regulacyjne
- 5. Jak przeprowadzić audyt krok po kroku?
- 6. Jakie narzędzia wykorzystać w audycie w branży life science?
- 7. Ile kosztuje wdrożenie audytu wewnętrznego?
- 8. Jakie są najczęstsze błędy w audycie w sektorze life science?
- 9. FAQ – najczęściej zadawane pytania
- 9.1. Jak często przeprowadzać audyt wewnętrzny w firmie life science?
- 9.2. Jakie certyfikaty powinien posiadać audytor w organizacji life science?
- 9.3. Czym różni się audyt wewnętrzny od inspekcji FDA?
- 9.4. Jak technologia zmienia audyt wewnętrzny w 2025?
- 9.5. Czy małe firmy life science też potrzebują audytu wewnętrznego?
- 10. Podsumowanie – kluczowe wnioski
Audyt wewnętrzny w branży life science wymaga niezależności zespołu, znajomości wymagań FDA/EMA oraz specjalistycznych narzędzi. Kluczem jest przestrzeganie standardów GxP, zachowanie ścieżek audytowych zgodnych z 21 CFR Part 11 oraz wykorzystanie platform do zarządzania ryzykiem i zgodnością.
Czym jest audyt wewnętrzny w branży life science?
Audyt wewnętrzny w sektorze farmaceutycznym i biotechnologicznym to niezależna ocena procesów, która weryfikuje skuteczność zarządzania ryzykiem, kontroli wewnętrznej oraz zgodności z wymaganiami regulacyjnymi FDA (Food and Drug Administration) i EMA (European Medicines Agency). W przeciwieństwie do innych branż, firmy działające w obszarze life science muszą spełniać standardy GxP (Good Practice Guidelines), które obejmują produkcję (GMP), badania kliniczne (GCP) oraz praktyki laboratoryjne (GLP).
Dlaczego audyt w farmacji jest wyjątkowy?
Branża life science podlega najsurowszym regulacjom ze względu na bezpośredni wpływ na zdrowie pacjentów. Według Gartner, inwestycje w narzędzia GRC wzrosną o 50% do 2026 roku właśnie ze względu na rosnącą złożoność wymagań compliance w regulowanych branżach.
Kluczowe regulacje obejmują:
- CFR 21 Part 11 – przepisy dotyczące dokumentów elektronicznych i podpisów cyfrowych
- GAMP 5 – wytyczne walidacji systemów informatycznych
- ALCOA+ – zasady integralności danych (Attributable, Legible, Contemporaneous, Original, Accurate)
Jak zapewnić niezależność audytu wewnętrznego?
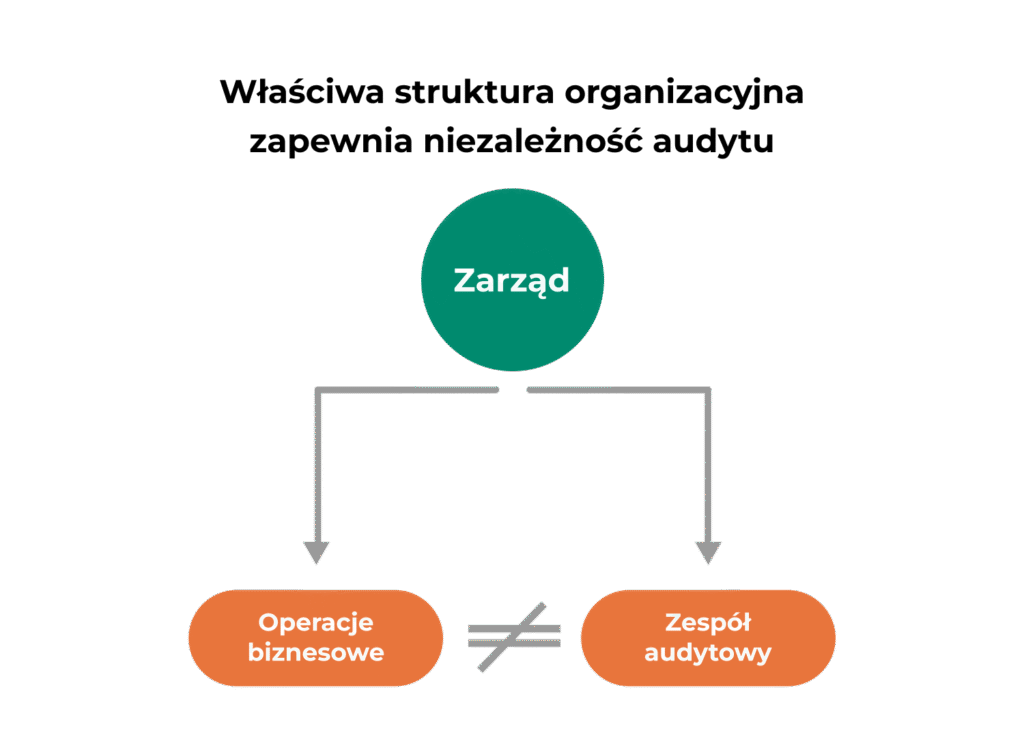
Niezależność to fundament wiarygodności audytu. Zespół audytowy musi być strukturalnie oddzielony od operacji biznesowych i raportować bezpośrednio do zarządu lub komitetu audytu. W praktyce oznacza to, że audytorzy nie mogą oceniać procesów, w których bezpośrednio uczestniczyli.
Organizacyjne mechanizmy niezależności
Najlepsze praktyki według Deloitte Internal Audit Hot Topics 2025 wskazują, że 82% funkcji audytu zgłasza zwiększony wpływ na organizację dzięki właściwej strukturze raportowania. Jej najważniejsze elementy to:
- Bezpośrednie raportowanie do komitetu audytu przy radzie nadzorczej
- Rotacja audytorów między różnymi obszarami co 2-3 lata
- Jasne procedury unikania konfliktu interesów
- Oddzielny budżet, niezależny od audytowanych działów
Najważniejsze wymagania regulacyjne
Firmy z branży life science funkcjonują w środowisku, gdzie regulacje zmieniają się szybciej niż w innych sektorach. Według badania Deloitte, wiele działań związanych z compliance wymaga znacznego wysiłku manualnego, a adopcja technologii cyfrowych jest dopiero w początkowej fazie.
Najważniejsze standardy i ich zastosowanie
| Standard | Obszar zastosowania | Częstotliwość aktualizacji |
| CFR 21 Part 11 | Dokumenty elektroniczne | Ciągła |
| GMP (21 CFR 210/211) | Produkcja farmaceutyczna | Co 2-3 lata |
| ICH Q10 | Systemy jakości | Co 3-5 lat |
| ISO 13485 | Wyroby medyczne | Co 5 lat |
Ścieżki audytowe zgodne z regulacjami
Wszystkie systemy elektroniczne w sektorze life science muszą generować automatyczne, niezmienne ścieżki audytowe. Każda zmiana w dokumencie elektronicznym musi zawierać:
- Identyfikację użytkownika (kto)
- Znacznik czasowy (kiedy)
- Rodzaj zmiany (co)
- Uzasadnienie (dlaczego)
Jak przeprowadzić audyt krok po kroku?
Skuteczny audyt wewnętrzny w branży life science składa się z pięciu faz, które zapewniają całościową ocenę zgodności.
Faza 1: Planowanie oparte na ryzyku
Rozpocznij od analizy ryzyka – możesz do tego celu wykorzystując macierz ryzyka, która pomoże Ci spriorytetyzować obszary audytu. Zidentyfikuj:
- Procesy krytyczne dla bezpieczeństwa pacjentów
- Obszary z historią niezgodności
- Nowe systemy wymagające walidacji
- Procesy podlegające zmianom regulacyjnym
Faza 2: Przygotowanie dokumentacji
Przygotuj listę żądanych dokumentów obejmującą:
- Procedury operacyjne standardowe (SOP)
- Dokumentację systemów informatycznych
- Raporty z poprzednich inspekcji FDA/EMA
- Rejestry szkoleń personelu
- Protokoły walidacyjne
Faza 3: Realizacja audytu
W trakcie audytu szczególną uwagę zwróć na:
- Zgodność z systemami kontroli wewnętrznej COSO
- Weryfikację ścieżek audytowych w systemach GxP
- Ocenę skuteczności kontroli krytycznych
- Dokumentację odstępstw i obserwacji

Faza 4: Raportowanie ustaleń
Raporty muszą być:
- Konkretne i poparte dowodami
- Kategoryzowane według poziomu ryzyka (krytyczne, poważne, drobne)
- Zawierające praktyczne rekomendacje
- Zgodne z wymogami śledzenia działań naprawczych (CAPA)
Faza 5: Monitorowanie działań naprawczych
Śledź wdrożenie rekomendacji poprzez zintegrowane systemy zarządzania ryzykiem, które automatyzują proces monitorowania i alarmowania o opóźnieniach.
Jakie narzędzia wykorzystać w audycie w branży life science?
Według Gartner Hype Cycle 2025, sztuczna inteligencja i automatyzacja stają się kluczowymi technologiami wspierającymi audyt i compliance. Jednakże 85% klientów Gartner używa więcej niż jednego narzędzia GRC, ponieważ rzadko zdarza się, aby jedno rozwiązanie spełnia wszystkie potrzeby.
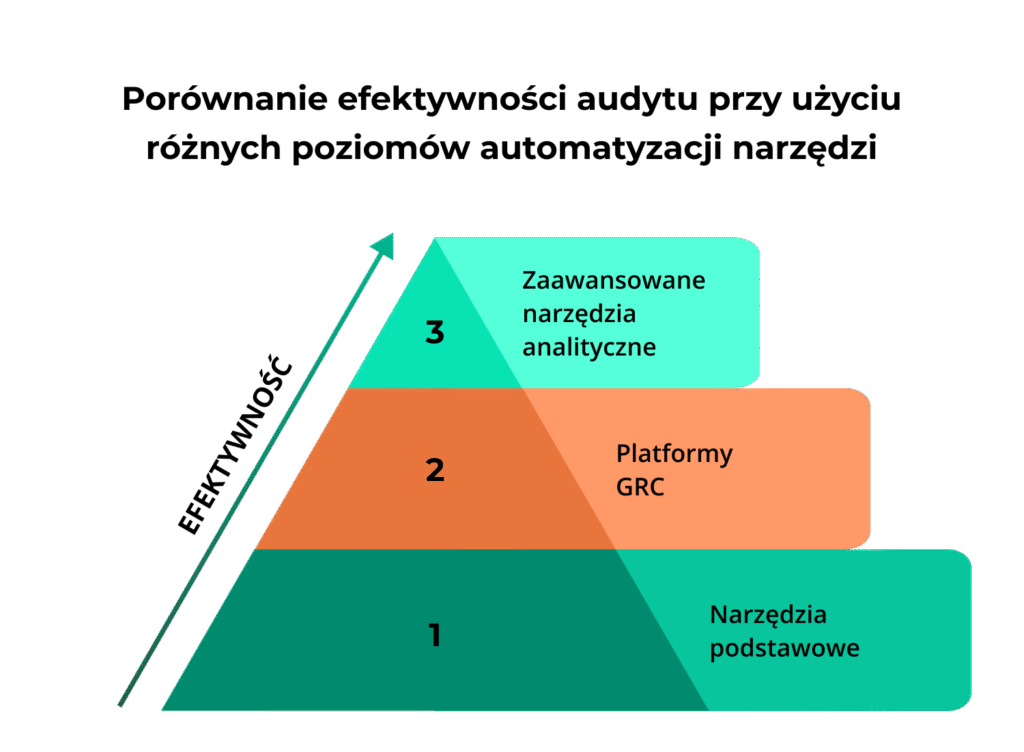
Wyróżniamy trzy poziomy narzędzi audytowych:
Poziom 1: Narzędzia podstawowe, obejmujące listy kontrolne zgodności z GxP, przewodniki audytu według GAMP 5 oraz szablony oceny integralności danych ALCOA+
Poziom 2: Platformy GRC, czyli specjalistyczne oprogramowanie do zarządzania audytem, które oferują centralne zarządzanie ryzykiem i zgodnością, automatyzację workflow audytowego, integrację z systemami ERP i QMS, dashboardy zarządcze z kluczowymi wskaźnikami czy automatyczne powiadomienia i alerty o zmianach regulacyjnych
Poziom 3: Zaawansowane narzędzia analityczne, które pozwalają na predyktywną analizę ryzyka z wykorzystaniem AI, automatyczne wykrywanie anomalii w danych, wizualizacja trendów compliance czy ciągłe monitorowanie kontroli.
Ile kosztuje wdrożenie audytu wewnętrznego?
Koszty audytu wewnętrznego w sektorze life science są znaczące, ale zwrot z inwestycji jest wymierny.
Analiza kosztów wdrożenia
- Personel audytowy: 80 000 – 150 000 PLN rocznie na audytora (w zależności od doświadczenia)
- Platformy GRC: 50 000 – 200 000 PLN rocznie (zależnie od wielkości organizacji)
- Szkolenia i certyfikacje: 10 000 – 30 000 PLN na osobę rocznie
- Konsultanci zewnętrzni: 800 – 1500 PLN/godz.
Zwrot z inwestycji (ROI)
Według OneTrust GRC Trends 2025, właściwe narzędzia compliance mogą zmniejszyć koszty nawet o 60% oraz przyspieszyć uzyskiwanie certyfikacji o 50%. Dodatkowo, uniknięcie jednej kary FDA (średnio 500 000 – 5 mln USD) zwraca wielokrotnie inwestycję w program audytu.
Jakie są najczęstsze błędy w audycie w sektorze life science?
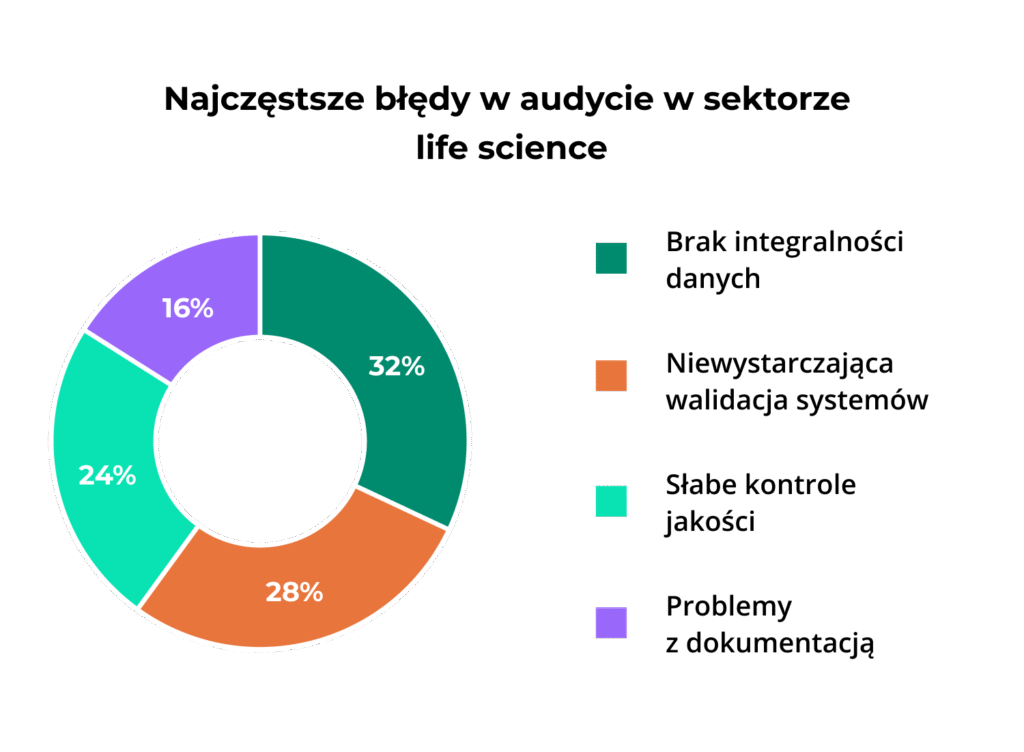
Na podstawie analizy warning letters FDA, najczęstsze problemy to:
- Brak integralności danych – nieodpowiednie ścieżki audytowe (32% warning letters)
- Niewystarczająca walidacja systemów – brak dokumentacji zgodnej z GAMP 5 (28%)
- Słabe kontrole jakości – nieefektywne procedury QA/QC (24%)
- Problemy z dokumentacją – niepełne lub nieaktualne procedury (16%)
Jak uniknąć typowych pułapek?
Wdrażaj ciągły audyt zamiast okresowego (shift z reactive do predictive), wykorzystuj AI do automatycznego wykrywania anomalii, integruj audyt z procesami CAPA i zarządzania ryzykiem, organizuj szkolenia dla pracowników nie tylko z procedur, ale z ich uzasadnienia.
Trendy w audycie w branży life science 2025
Według badania Deloitte, funkcje audytu wewnętrznego ewoluują w kierunku ciągłego zapewnienia zgodności zamiast okresowych kontroli.
Wiodącymi trendami technologicznymi są przede wszystkim te obejmujące sztuczną inteligencję i uczenie maszynowe, które pozwalają na:
- Predyktywną analizę ryzyka compliance
- Automatyczne wykrywanie odstępstw od procedur
- Inteligentne próbkowanie populacji audytowej
Po drugie, blockchain w łańcuchu dostaw:
- Niezmienne zapisy transakcji surowców farmaceutycznych
- Automatyczna weryfikacja certyfikatów dostawców
- Zwiększona przejrzystość łańcucha dostaw
A także ciągły monitoring i IoT, czyli:
- Sensory monitorujące parametry krytyczne 24/7
- Automatyczne alerty o odchyleniach
- Real-time dashboardy dla zarządu
FAQ – najczęściej zadawane pytania
Jak często przeprowadzać audyt wewnętrzny w firmie life science?
Częstotliwość zależy od oceny ryzyka. Obszary wysokiego ryzyka (systemy krytyczne, produkcja) powinny być kontrolowane minimum raz w roku. Obszary umiarkowanego ryzyka co 2-3 lata. Dodatkowo, należy stosować audyty ad-hoc przy znaczących zmianach w procesach, incydentach jakościowych lub nowych wymaganiach regulacyjnych.
Jakie certyfikaty powinien posiadać audytor w organizacji life science?
Minimalne wymagania to wykształcenie w naukach ścisłych (takich jak farmacja czy biotechnologia), certyfikat CIA (Certified Internal Auditor) lub podobny, znajomość GxP i regulacji FDA/EMA oraz 3-5 lat doświadczenia w branży. Pożądaną cechą jest również certyfikat CISA (Certified Information Systems Auditor), ze względu na rosnącą rolę IT.
Czym różni się audyt wewnętrzny od inspekcji FDA?
Audyt wewnętrzny jest proaktywny, prowadzony przez organizację dla poprawy procesów i zarządzania ryzykiem. Inspekcja FDA ma charakter weryfikacyjny, prowadzona jest przez regulatora, z możliwymi konsekwencjami prawnymi (warning letters, import alerts). Skuteczny audyt wewnętrzny przygotowuje firmę na inspekcje regulacyjne.
Jak technologia zmienia audyt wewnętrzny w 2025?
AI i automatyzacja przekształcają audyt z reaktywnego w predyktywny. Zamiast wykrywać problemy post factum, systemy przewidują ryzyka na podstawie wzorców danych. Według badań Gartner, do 2026 roku 50% organizacji w life science będzie używać AI do ciągłego monitorowania compliance.
Czy małe firmy life science też potrzebują audytu wewnętrznego?
Tak, choć w uproszczonej formie. Nawet startup biotechnologiczny musi spełniać wymogi GxP jeśli planuje badania kliniczne. Małe firmy mogą rozpocząć od podstawowych list kontrolnych i zewnętrznych audytorów, stopniowo budując wewnętrzne kompetencje wraz z rozwojem.
Podsumowanie – kluczowe wnioski
Skuteczny audyt wewnętrzny w sektorze life science to fundament bezpieczeństwa produktów i zgodności regulacyjnej. Na jego elementy składają się:
- Niezależność organizacyjna – bezpośrednie raportowanie do komitetu audytu
- Znajomość regulacji – CFR 21 Part 11, GxP, GAMP 5
- Nowoczesne narzędzia – zintegrowane platformy GRC z możliwościami AI
- Ciągłe doskonalenie – ewolucja z audytu okresowego do ciągłego monitoringu
Inwestycja w profesjonalny audyt wewnętrzny zwraca się wielokrotnie poprzez uniknięcie kar regulacyjnych, poprawę efektywności operacyjnej i budowanie zaufania pacjentów. W dynamicznie zmieniającym się środowisku regulacyjnym w 2025, roku firmy z sektora life science muszą traktować audyt nie jako obowiązek, ale jako strategiczne narzędzie konkurencyjności.
Chcesz dowiedzieć się więcej? Sprawdź nasz przewodnik po zarządzaniu ryzykiem w audycie wewnętrznym lub skontaktuj się z nami w celu bezpłatnej konsultacji dotyczącej optymalizacji procesów audytowych w Twojej organizacji.